6 Vattnets kemi
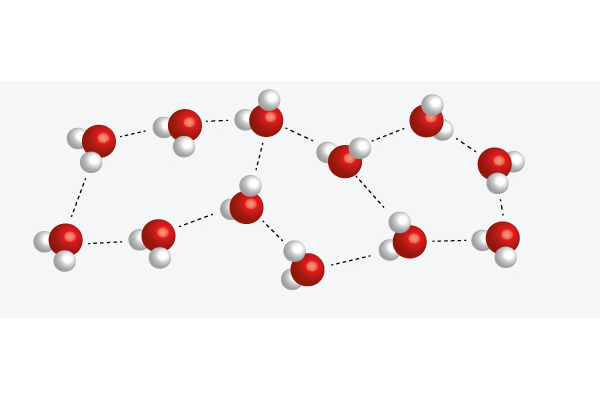
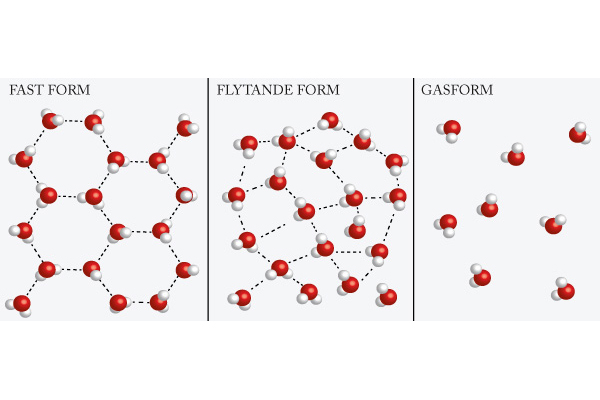
Vattnets tre tillstånd
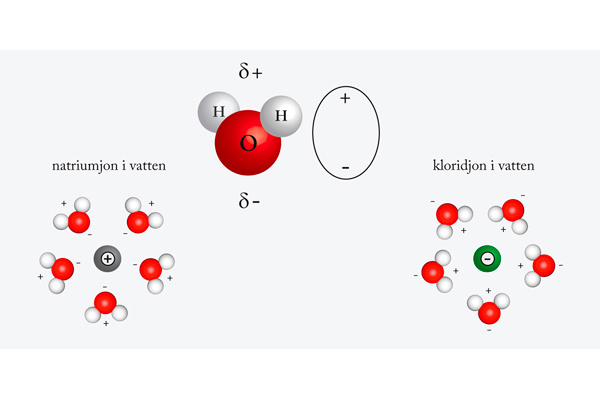
Vatten som lösningsmedel
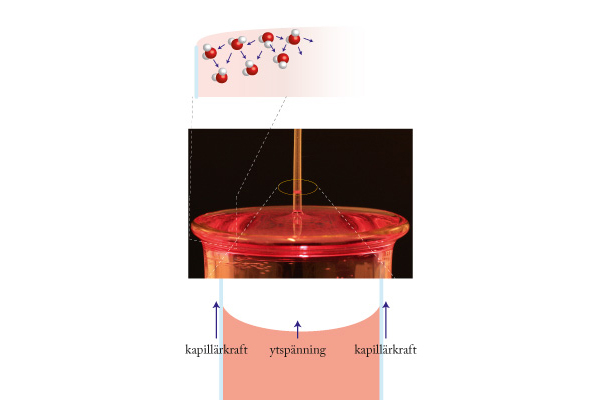
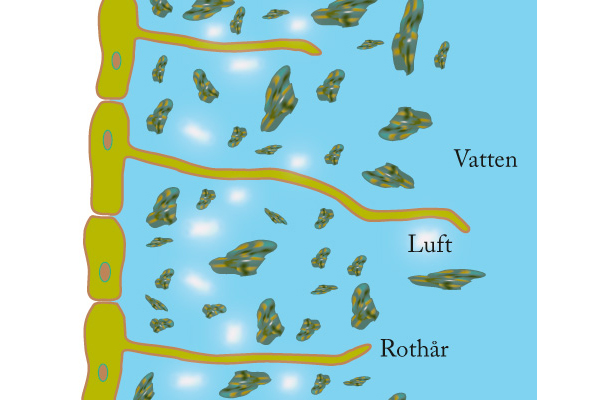
Ytspänning och transport
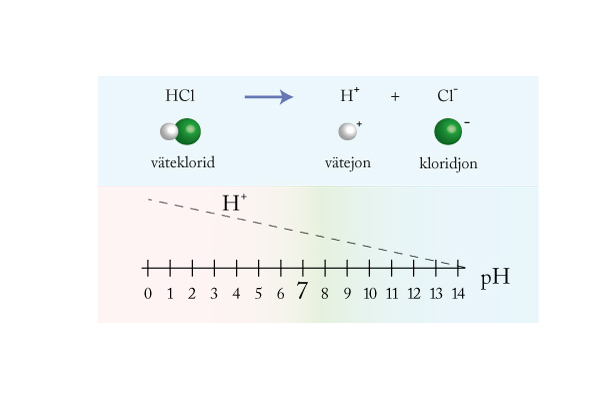
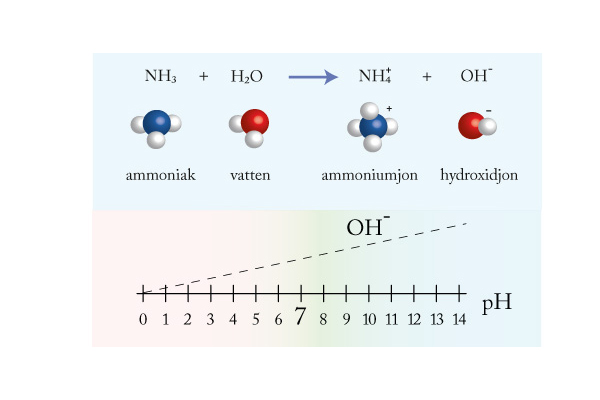
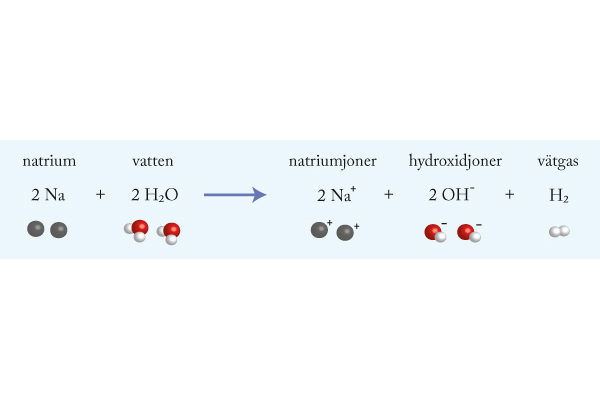
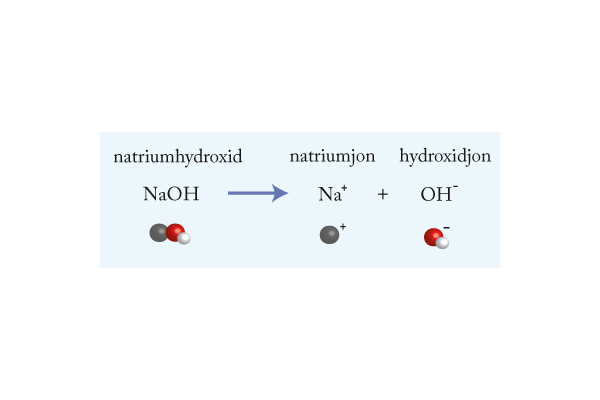
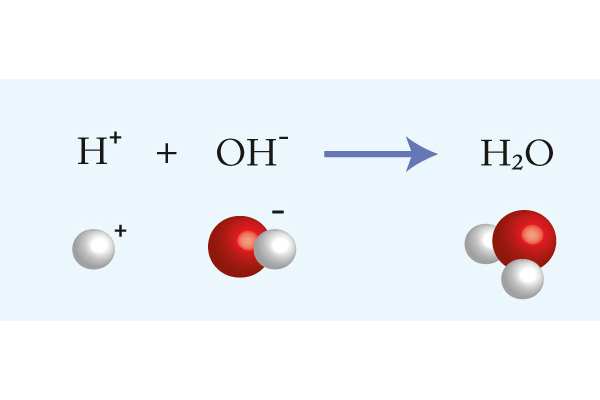
Syror och baser
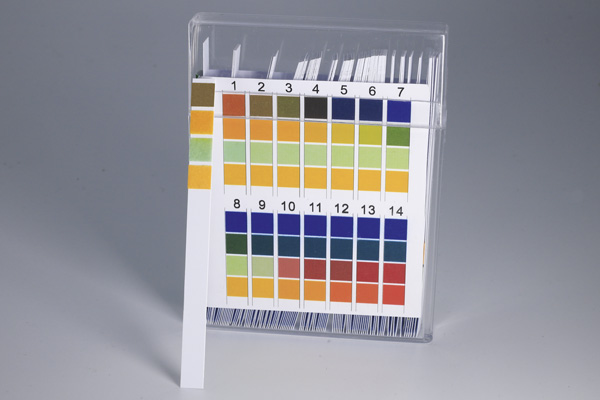
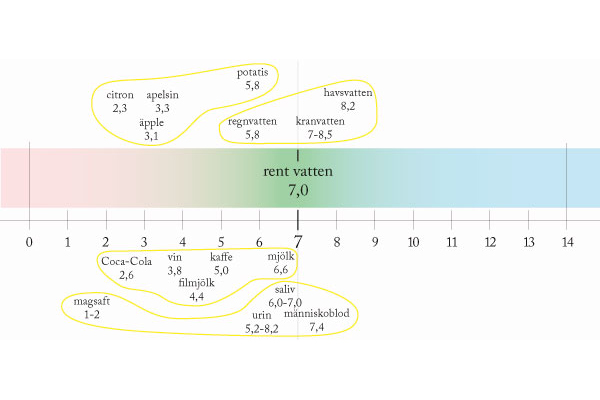
Mäta surt och basiskt
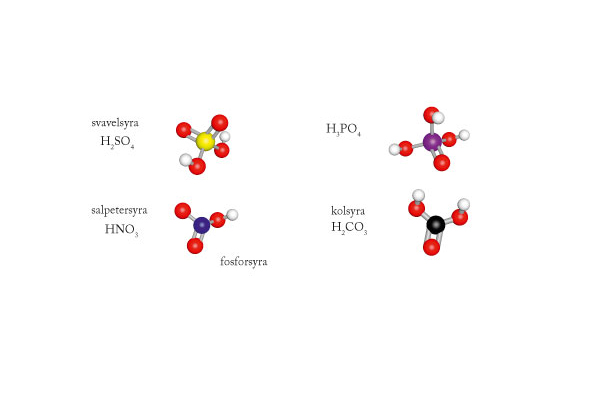
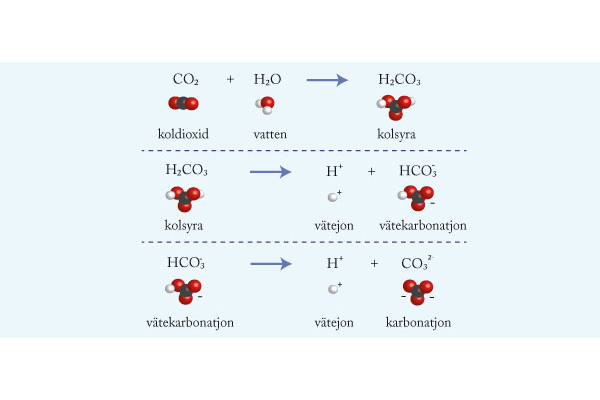
Starka och svaga syror
Begrepp Kapitel 6

Länkar
Film om vattnets egenskaper från UR (2 min 16 sek)
Film om salter och vattenlösning från UR (1 min 51 sek)
Film om baser från UR (2 min 16 sek)