Kapitlet handlar om hur metaller tillverkas och används och svarar på följande frågor: Vilka egenskaper gör metaller användbara? Vad är skillnaden mellan ädla och oädla metaller? Vad händer vid korrosion och hur kan den förhindras? Vad sker vid oxidation och reduktion? Hur kan ren metall framställas ur mineral? Hur fungerar batterier? Vad sker vid elektrolys och hur kan den användas?
1. Kolstål är hårdare än rent järn och rostfritt stål rostar inte så lätt.
2. Koppar och tenn
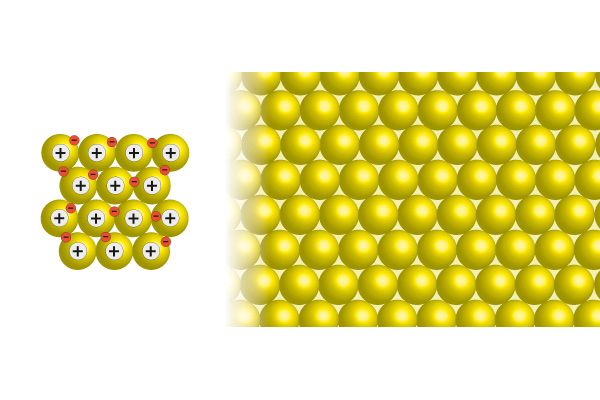
3. Metallglans, förmåga att leda elektricitet och värme, formbarhet
4. Valenselektronerna är inte bundna till enskilda atomer utan är rörliga i metallen.
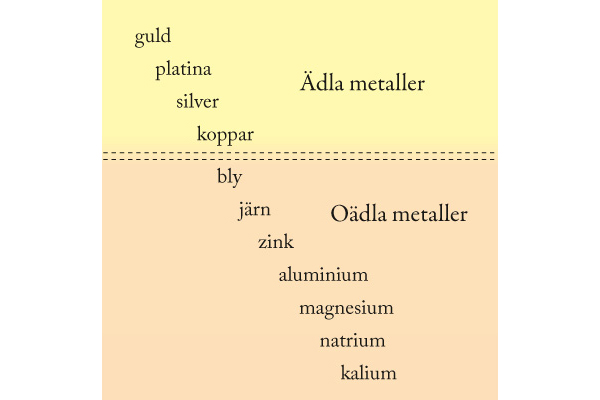
5. Krom
6. Det bildas ett tätt oxidskikt på ytan och detta skyddar metallen innanför.
7. Aluminium har lägre densitet, vilket gör flygplanet lättare.
8. Anod (minuspol), katod (pluspol) och elektrolyt
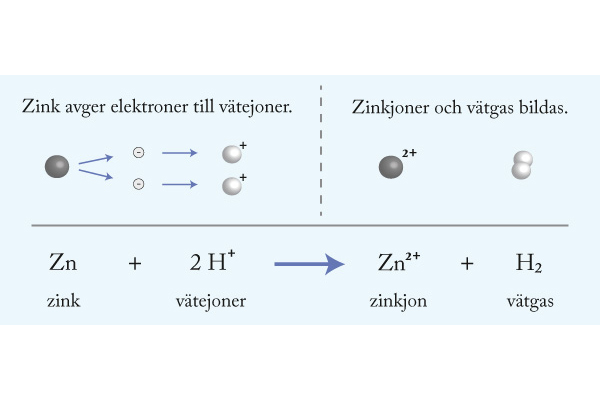
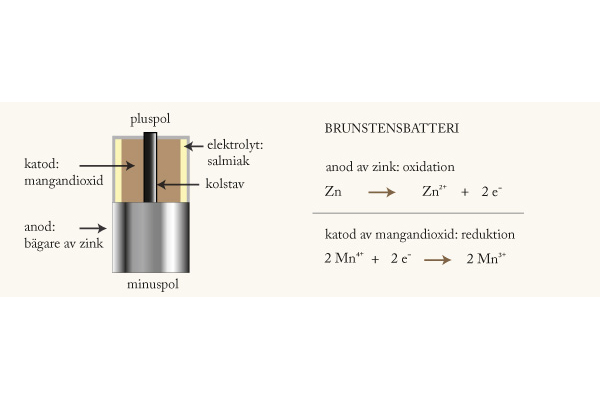
9. Zink
10. Tillverka syrgas och vätgas, framställa rena metaller ur mineral, lägga på en metallyta på ett föremål av en annan metall
1. Metaller leder värme
2. Elektronerna attraheras av metallatomerna genom att minusladdning dras till plusladdning, men binds inte till enskilda atomer. Metallen binds ihop genom att attraktionskrafterna är riktade åt olika håll.
3. (Felaktig fråga, se uppgift A7.)
4. Zink är en oädel metall som oxideras vid kontakt med en syra. När vätejoner i den sura lösningen tar upp elektroner från zink bildas vätgas.
5. Produkten vid reaktionen blir vatten i stället för koldioxid. Därigenom sker ingen ökning av växthusgaser i atmosfären.
6. En metall kan skyddas mot korrosion genom att den antingen har kontakt med en mer oädel metall som oxideras lättare, eller genom att en annan metall bildar ett tätt oxidskikt som skyddar.
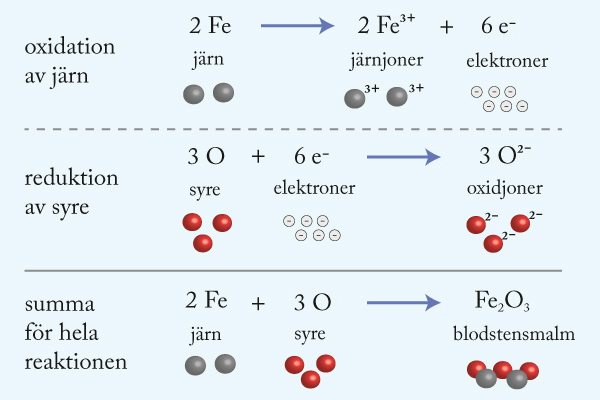
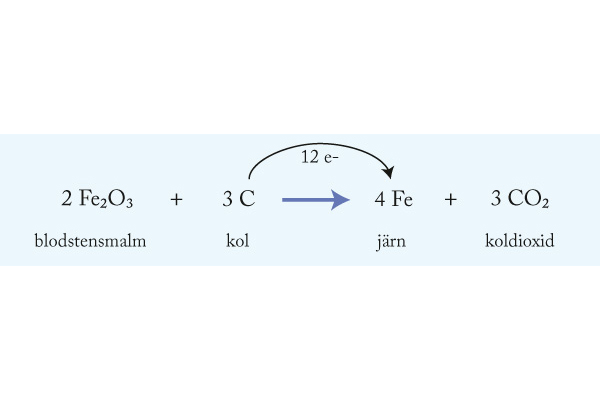
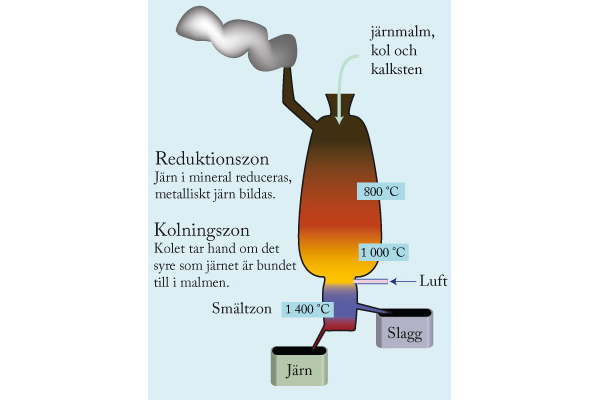
7. Kolet tar upp det syre som fanns bundet till järnatomer i järnmalmen. Kolet fungerar som reduktionsmedel vid processen.
8. Elektrolyten får inte leda elektroner för då blir det ingen ström i den yttre kretsen. Samtidigt måste den kunna leda joner för att strömmen ska kunna ledas runt.
9. Uppladdningen gör att reaktionerna drivs ”baklänges” så att de ursprungliga materialen återställs.
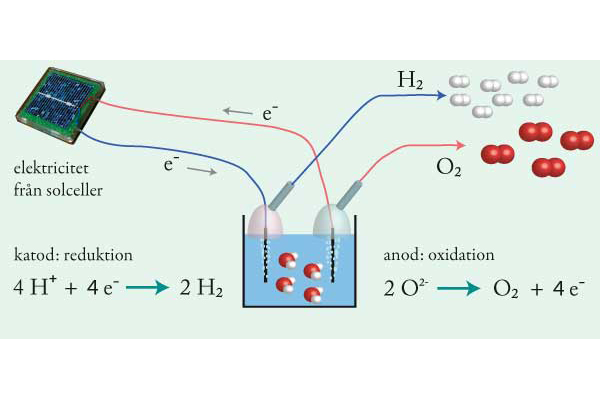
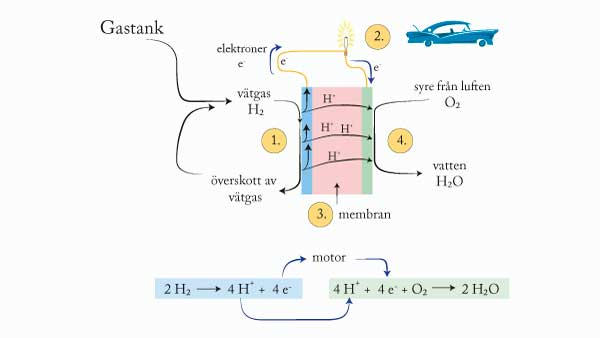
10. Vätgas kan genom elektrolys skapas med hjälp av elektricitet från exempelvis vindkraft och solceller. Den kemiska energi som finns i vätgas kan sedan användas till att driva fordon eller ge elektricitet på en annan plats eller vid ett tillfälle när det inte blåser eller inte är soligt.
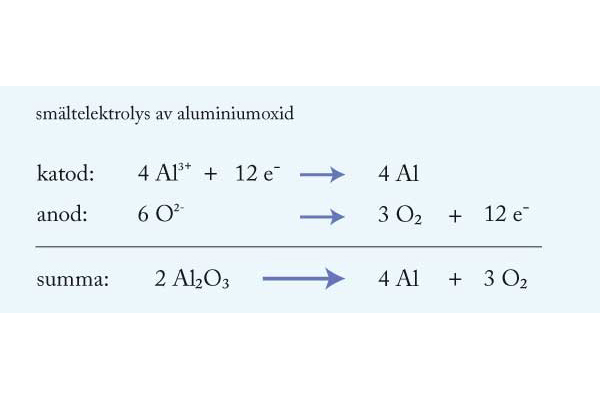
Bilderna i kapitlet.Några av dem återfinns i filmen.